Moleküler İletişim: Gut Mikrobiyotası ve Beyin
Yazan: Tuğçe Gül Yeşilyayla
Düzenleyen: Ümit Sözbilir & Rabia Selen
Özet: İnsan vücudu; endokrin sistem, bağışıklık sistemi ve merkezî sinir sistemi üzerine son derece önemli işlevleri bulunan milyonlarca minik canlıya ev sahipliği yapmaktadır. Bu canlıların ürettiği biyolojik moleküller duygu durumu, ruh hâli (mood), davranış, öğrenme, hafıza, bağışıklık sistemi cevabı gibi süreçlerde etkin rol almakta, bazı hastalıkların gelişiminde ise rolü olabileceği düşünülmektedir. Bu mikroorganizmalar yani minik canlılar çeşitli iletişim kanalları aracılığıyla vücut sistemleri ve beyin arasında karşılıklı etkileşimde bulunmakta ve böylece “gut-beyin eksenini” oluşturmaktadır. Doğum şekli, beslenme biçimi, gebelik süresi, ilaç kullanımı ile bu canlıların sayısı azalabilir, artabilir veya bazı türler yok olabilir. Tüm bunların sonucunda gülebilir, ağlayabilir, beyin sağlığınız etkilenebilir veya hasta olabilirsiniz.
1. Giriş
Bağırsaklarımızdaki, ev sahipliği yaptığımız mikroorganizmaların, genlerimizi, epigenetiğimizi,1 fizyolojimizi, duygularımızı ve kişiliğimizi etkilediğini hâlâ bilmeyen var mı? “İkinci beyin”, “gut-beyin ekseni2”, “mikrobiyom” gibi kelimeler son 10 yılda sıklıkla karşımıza çıkmakta. Son zamanlarda bu canlıların sadece bağırsak sistemimizde değil vücudumuzun hemen hemen her yerinde yaşayabildikleri keşfedildi [1]. Muhtemelen bu canlıların vücudumuza olan etkisi sandığımızdan daha fazla. Bu küçük canlılar bizim mutlu veya üzgün olmamızı sağlayabilir, hasta olmamıza neden olabilir veya davranış şeklimizi değiştirebilir. [2] Peki bunu nasıl yaparlar? Doğum şeklimizin sezaryen veya vajinal doğum şekline göre olması gut3 mikrobiyotamızı4 dolayısıyla kişiliğimizi etkileyebilir mi? Mikroorganizmaların bizi nasıl etkilediğine değinmeden önce gelin moleküler gözlüklerimizi mikrobiyotalara çevirelim.
2. Mikrobiyota Nedir?
Mikrobiyota: vücut yüzeyleri ve boşluklarında yaşayabilen, ürettikleri metabolitlerle hücresel metabolizmayı ve bağışıklık sistemini etkileyebilen mikroorganizma topluluklarıdır. Bu mikroorganizmalar ise virüsler, arkeler, bakteriler, ökaryot canlılar (protozoalar (tek hücreli ökaryotlar), mantarlar (Latince: fungus: mantar, fungi: mantarlar)) gibi çeşitlilikten oluşmaktadır [3]. İnsan vücudunda Firmicutes, Bacteriodetes, Proteobacteria ve Actinobacteria baskın filum5 grubunu oluştururken Verrucomicrobia ve Fusobacteria azınlık filum grubunu yansıtmaktadır [3] [4]. Mikrobiyom (mikrobiyal genom) terimi ise bu canlıların sahip olduğu genetik materyal bütününe verilen ad olarak özetlenebilir [5]. İnsan gut mikrobiyomunun 3,3 milyondan fazla gene sahip olduğu tahmin edilmekte. ENSEMBL veri tabanındaki bilgilere göre ise insan 23 bin 285 protein kodlayan gene sahiptir. Bu durumda insan vücudu kendi genomundan daha fazla büyüklükte bakteriyel genoma sahip durumdadır. Belki de mikrobiyota insan için ikinci genomdur denilebilir. İnsan genomu ise mikrobiyomla çift taraflı, doğrudan veya dolaylı yollarla etkileşim hâlindedir. [6]
Gut mikrobiyotası kolonda sayıda hücreye ulaşarak kocaman büyüklükte mikroorganizma seviyesini temsil etmektedir. İnsan gut mikrobiyotasında yaygın olan 1.000-1.500 arasında bakteri çeşitliliği raporlanmıştır. Her insan da aşağı yukarı 150 farklı türde canlıya ev sahipliği yapmaktadır. [7] İsminden anlaşılacağı üzere küçük boyutta olan mikroorganizmalar bir araya geldiklerinde dev bir topluluğu oluşturmaktadır. Bugün iyi biliyoruz ki bu küçük canlılardaki minik değişimler bizde davranışsal ve bilişsel değişimlere neden olabilir, sağlıklı-sağlıksız bir bünyede büyük roller oynayabilir. İnsan sağlığı için iyi bir gut mikrobiyotası hastalıklara karşı koruyucu etki sağlarken, sağlıklı sindirim sistemine, vitamin üretimine, damarlanmaya (anjiyogenez), epitel hücre olgunlaşmasına, nörotransmitter (neurotransmitter) adı verilen kimyasal sinir iletim moleküllerinin üretimine, özellikle yağ metabolizmasına, mutlu ve huzurlu bir ruh hâli ile düzenli sinir sistemi işlevlerine büyük katkı sağlamaktadır. Kötü gut mikrobiyotası ise depresyon, anksiyete, bipolar bozukluk, yeme bozuklukları, epilepsi, nörodejeneratif hastalıklar, multiple skleroz (multiple sclerosis (MS)), huzursuz bağırsak sendromu, otizm spektrum bozukluğu, obezite ve kanser riskini arttırabilmektedir. [4] [6] [8] Burada iyi ve kötü mikrobiyotadan kastımız aslında olumlu veya olumsuz işlevlere sahip mikroorganizma türlerinin toplam seviyesidir. Sonuç olarak bu canlıların varlığı da yokluğu da sorun olabilmektedir.
3. Gut Mikrobiyotası: İşlevleri ve Metabolik Ürünleri
Gebeliğin ilk gününden ve doğumdan itibaren ilk mikrobiyota yapımız oluşmaya başlamakta ve ihtiyar bir hanımefendi/beyefendi oluncaya kadar büyüyüp değişmektedir. Bir asırdan fazla süren aktif araştırmaların ardından rahim, plasenta, amniyon sıvısı ve mekonyumun6 (meconium) steril olduğunu ve mikrobiyotanın doğumdan sonra kazanıldığı iddia edilmişti. Ancak çalışmalar öyle göstermedi. Son DNA-tabanlı PCR ve DNA dizileme yöntemlerinde plasentada, amniyon sıvısında ve mekonyumda bakteri topluluklarının varlığı gösterildi. [9] Aslında yetişkinlikten yaşlılığa gut mikrobiyotasındaki değişimler için kesin bir yaş aralığı yoktur, değişimler kademeli bir şekilde gerçekleşir ve bireyden bireye farklılık göstermekle beraber birçok dış etmene bağlıdır [10].
Mikrobiyom bizde kodlanamayan çeşitli proteinleri bizim ve kendisi için kodlayabilir. Aslına bakarsanız içimizde yaşayan bu küçük canlıları varlığından dolayı değil bizim için ürettiklerinden dolayı seviyoruz. Yediğimiz lifli yiyeceklerden, elma veya domatesten bile yağ asitleri üretecek kadar çalışkan canlılardır lakin bir o kadar da bizim için tehlikeli olabilirler. Bozulmuş gut mikrobiyotasına (disbiyosiz) değinmeden sağlıklı gut mikrobiyotasının işlevlerine odaklanmak gerekirse bu işlevler üç temel başlık altında değerlendirebilir: metabolik, koruyucu ve yapısal. [11]
3.1. Metabolik
İnsan sindirim sistemi karbonhidratların %85’ini, yağ ve proteinlerin ise yaklaşık %66-95’ini sindirebilir. Geri kalan kısımdaki sindirimde, besin emiliminde ve liflerden yararlı moleküllerin üretiminde gut mikrobiyotası devreye girmektedir. Gut mikrobiyotası; besin liflerinden kısa zincirli yağ asitleri (KZYA) (format, asetat, bütirat, propiyonat, valerat, hekzonat, izovalerat), metanol veya etanol gibi alkol türevleri, bazı gaz molekülleri, laktat ve süksinat gibi organik moleküller üretebilmektedir. Bunun yanı sıra farklı tipte proteinler (nitrik oksit, amonyak, triptamin, fenetilamin, spermin, spermedin) ve aminoasitler (lösin, izolösin, valin, triptofan), lipidler, ikincil safra asitleri (deoksikolik asit, litokolik asit), kolin, polifenoller (ürolithin n-fenil naringenin), vitaminler (K ve B grupları), nörotransmitterler (dopamin, GABA7, 5-HT8, asetilkolin) ve ismini yazamayacak kadar fazla sayıda molekül üretebilmektedir. [11] [12]
- KZYA’lar sıkı protein bağlarını düzenleyerek bağırsak epitelyal hücre bütünlüğünün korunmasında rol oynamaktadır [12].
- KZYA’lar kan-beyin bariyer geçirgenliğini ayarlar, nöroinflamasyon ve mikrogliaların9 etkinliklerini düzenlemeye yardım eder [12]. Özellikle bütiratın Alzheimer, Parkinson ve Huntington hastalıklarında yararlı etkileri olduğu gösterilmiştir [6].
- Gut- hormon bağımlı sinyallerde, bağışıklık sisteminde, adipoz doku dengesinde, iştahta, nöronların aktivitesinde ve iç organlara ait reflekslerde esaslı rol oynamaktadır. Ayrıca KZYA’lar mikrogliaların olgunlaşmasına ve işlevlerine yardımcı olmaktadır [12].
- KZYA’lar GABA ve serotonin üretimini uyarabilirler [12].
- Mikrobiyota- bağlı triptofan nöral (neural10) işlevi düzenlemeye yardım eder [13].
- Triptamin; bağırsaklardaki enterokromaffin hücrelerden serotonin salgılanmasını uyarır [14].
- Üretilen vitamin çeşitlerinden K2 vitamini kardiyovasküler hastalık riskini azaltmakta, B5 ve B12 ise sinir sistemi işlevlerinin düzenli yürütülmesine katkı sağlamaktadır [11].
3.2. Koruyucu
Gut sistemi kendi ürettikleri moleküller sayesinde kendi iç bağışıklık sistemini (mukozal bağışıklık sistemi) geliştirmiştir. Bu gut-bağışıklık sistemi yakaladığı bakterileri tespit edip öldürerek bu bakterilerin intestinal dokuya karışmasını engeller. Herhangi bir inflamatuar cevapta ise insan bağışıklık sistemine ihtiyaç duymadan mukoza yüzeyinde kendi bağışıklık sistemi cevabını verebilir. Özetle gut mikrobiyotası doğal ve edinsel bağışıklık sistemini aktive edebilir. İntestinal sistemdeki epitelyal hücreler tarafından antimikrobiyal peptitler salgılamakta ve böylece patojenlerin epitelyal dokuya girmesini engelleyebilmekte. Ayrıca immünoglobin A (IgA) da salgılayarak içsel toksinlerden ve patojen mikroorganizmalardan koruma görevini gerçekleştirebilir. [11]
3.3. Yapısal
“Tüm kötülüklerin başı kötü sindirimdir.” ve “Ölüm bağırsaklarda oturur.” diyen Hipokrat, milattan önce 400’lü yıllarda bile yararlı floraların dengesinin aşırı bozulmasının gut geçirgenliğine dolayısıyla ölüme yol açabileceğinin farkındaydı. Bu nedenle gut sistemine yapısal destek, hücreler arası bağlantıların düzenlenmesi, bu hücrelerdeki villus ve kript (villi and crypt11) olarak isimlendirilen yapıların gelişimi, villusta küçük damarlanmaların gerçekleşmesi gibi rolleri mikrobiyota üstlenmiştir. [11]
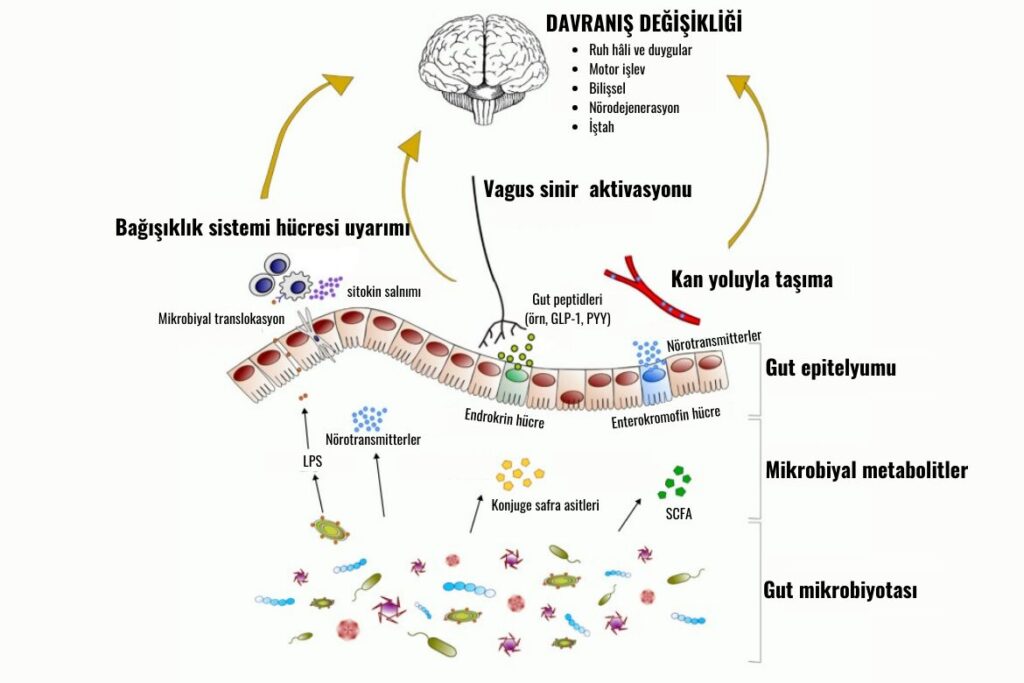
4. Gut-Beyin Ekseni
Gut-Beyin Ekseni olarak adlandırdığımız iletişim kanalı, gastrointestinal sistem ve merkezî sinir sistemi arasında gerçekleşen bu sistemlerin karşılıklı olarak etkileşime girdikleri bir yolaktır. Bu eksendeki karşılıklı konuşma ise birden fazla iletişim yolağının çalışması ile gerçekleşmektedir. Direkt olarak iletişim omurilik üzerinden otonom sinir sistemi ile gerçekleşir. Bu eksendeki iletişim yolaklarını immün, endrokrin (hipotalamik-hipofiz-adrenal eksen (hypothalamic-pituitary-adrenal [HPA] axis12)) sinyal yolakları ve otonom sinir sistemi (özellikle vagus siniri (VS)) olarak sıralayabiliriz. 10. Kraniyal sinir olan vagus siniri, boyundan uzanan ve iç organlar ile beyin arasındaki bağlantıyı gerçekleştiren en hızlı çalışan iletişim kanalıdır. VS; afferent (götürücü) ve efferent (alıcı) nöronları içermekte ve iç organların durumu, sindirim sistemi, kalp atışı, duygu durumu ve immün sistem cevabı konusunda beyini bilgilendirerek elçi görevini üstlenmektedir. Ayrıca VS; mikrobiyotaya ait sinyalleri doğrudan alabilen mekanizmalara sahipken aynı zamanda beynin salgıladığı sinyal molekülleriyle mikrobiyotayı da kontrol edebilir. [5] [12] Bu eksendeki herhangi bir bozulma anksiyete, depresyon, nörodejeneratif hastalıklar, yeme bozuklukları, epilepsi, inme, otizm spektrum bozukluğu ve daha birçok hastalığın gelişimine neden olmaktadır [4] [6] [8].
5. Doğum Şekli, Emzirme, Antibiyotik kullanımı ve Gebelik Süresi
Hayatımızın ilk bin günü (beklenen gebelik süresi ve doğum sonrası ilk iki yıl) aslında sandığımızdan çok daha fazla önemli. Yaşamın ilk yılları sağlıklı bir vücut gelişimi veya hastalıkların temelini oluşturmaktadır. Temelimiz ne kadar sağlam ise hastalıklara da bir o kadar dirençli olup ruh sağlığımızı da güçlü bir şekilde koruyabiliriz. Gebelik yaşı, doğum şekli, emzirilme, maternal (anne) koşullar, intrapartum (doğum sırasındaki) koşullar, antibiyotik kullanımı, coğrafik ve kültürel farklılıklar gibi bu geniş listedeki maddeler bakteri kolonizasyonunu dolayısıyla bizi etkileyecektir.

5.1. Doğum Şekli
Normal doğumda, fetüsün vajinadan çıkması mikrobiyotaya maruziyet bakımından ilk ve temel yoldur. Vajinal doğumla doğan infant (doğumdan itibaren ilk bir yaş), vajinada yaşayan bakterileri yutmakta ve maruz kalmaktadır. Yapılan araştırmada sezaryen doğuma kıyasla vajinal doğumla dünyaya gelen infantların bağırsaklarında bifidobacterium ailesinde önemli bir artış görülmüştür. Bu bakteri türleri ise Bifidobacterium türleri olan B. Catenulatum ve B. Longum’u kapsamaktadır [17]. Annenin doğum şekli infantların gut mikrobiyotasındaki türlerin sayıca büyümesi ve gelişmesi için önemli olabilmektedir. Tabii bu duruma ilk beş yıl sağlıklı beslenme, prebiyotik alımı ve emzirilme de büyük katkı sağlamaktadır. [18] [19]
5.2. Emzirilme
Anne sütü; sindirilemeyen oligosakkaritler, bağışıklık sistemi destekçileri, biyoaktif moleküller, hormonlar, sitokinler, yararlı bakterileri içeren ve toplam 200 farklı molekülü barındıran eşsiz bir yaşam kaynağıdır. Kültür tekniklerine ve moleküler tekniklere dayanan son çalışmalarda anne sütündeki lactobacilli ve bifidobacteria ailesinin ml başına sütte 10 ve koloni oluşturduğu gösterilmiştir. [19] [20] 
5.3. Antibiyotik Kullanımı
Antibiyotik kullanımının etkisinin incelendiği çalışmalarda ilk olarak dirençli mikroorganizmaların seçilimi incelendi. Ancak antibiyotik kullanımının gut mikrobiyotasının oluşması yani bakteriyel kurulum (bacterial establishment) üzerine etkisi çalışmalarda zayıf kaldı. [19] Yine de birçok çalışmada antibiyotik tedavisine maruz kalmış infantların kısa bir süre için bakteri profilinde değişiklikler olduğu rapor edilmiştir. Aslında bu alandaki çalışmaların temel özelliği antibiyotik kullanımının biyoçeşitliliği azaltmasıdır. Potansiyel olarak patojen bakterilerin ve dirençli mikroorganizmaların artması, potansiyel olarak yararlı bakteriler olan bifidobacteria ve lactobacilli ailesinin azalmasıyla ilişkilidir ve çalışmada da bu şekilde rapor edilmiştir [22]. İşin zor tarafı ise bu infantlardaki patojen mikroorganizmaların yani disbiyosiz durumunun çalışmalarda görülebilmesi birkaç haftayı bulmaktadır. Yani infantlarda antibiyotik etkisinden dolayı gerçekleşen değişken mikrobiyota seviyeleri hemen analiz edilememektedir. Bu etkinin sonuçlarını tam olarak açıklayabilmek uzun sürebilmektedir. [12] [19]
5.4. Gebelik Süresi
Gebelik süresi de bakteriyel kurulum açısından temel etkenlerden bir tanesidir. Prematüre yenidoğanların tam zamanında doğan yenidoğanlara kıyasla anormal bakteriyel profile sahip olabileceği bilinmektedir. Prematüre yenidoğanların bakteriyel kurulumundaki temel fark mikrobiyota profillerindeki büyük dengesizliklerdir. [19] [23] [24] [25] Anneden köken alan Bacteroides ve Bifidobacterium veya enterobacteria gibi bakteri cinsleri prematüre yenidoğanlarda normal sürede doğan yenidoğanlara kıyasla doğumla kazanılmadığı için bakteriyal kurulumda gecikme yaşanmaktadır. Ve bu prematüre yenidoğanların mikrobiyotalarında da çevredeki staphylococci bakteri ailesi yüksek seviyede görülmesine sebep olmuştur. Toparlamak gerekirse prematüre yenidoğanların annenin vajinasına temas edemediği, annelerinden hızla ayrıldığı için mikrobiyota seviyelerinin normal zamanda dünyaya gelen yenidoğanlara göre farklılık gösterdiği görülmektedir. [12] [19]
Gelecek Üzerine
Gut- beyin ekseni arasında gerçekleşen eşsiz özellikteki sistem bizi biz yapan birçok özelliğiniz için kilit eleman rolündedir. Tarihin eski zamanlarından bugünümüze kadar geçen süreçte bu iletişim hem evrimsel açıdan hem biz insanlar açısından hem de bu küçük canlılar açısından karşılıklı yarar veya zarar ilkesine göre çalışabilmektedir. [26] Tarihte de mikrobiyotanın önemi anlaşılmış olup atalarımız; gut ile duygular, ruh hâli ve davranış arasında bir bağlantı olduğunu gözlemlemiştir [27]. Dışkı mikrobiyal nakli (faecal microbial transplant (FMT)); Don-jin Hanedanlığından beri Çin geleneksel tıbbında (4. yüzyıl) ve Antik Yunan’da kullanılmıştır [28] [29]. FMT; sağlıklı bireyin dışkısının, gut mikrobiyotası değişen hasta bireye aktarılması şeklinde özetlenebilir. FMT; 4. yüzyıl gibi çok eski tarihlerden itibaren hasta bireylere uygulanmış, günümüzde de modern versiyonuyla çeşitli rahatsızlıklar için bir tedavi seçeneği haline gelmiştir [30]. Ayrıca bu FMT; 17. yüzyılda İtalyan Anatomist Fabricius Acquapendente tarafından da araştırılmıştır [31]. Hipokrat’ın, İbni Sina’nın, Galen’nin, Gaius Plinius’un eserlerinde mikrobiyotanın önemine değinildiğini görebiliriz [32]. Doğum şekli, beslenme biçimi veya genetik yapısı farklı olan kişiler arasında mikroorganizma çeşitliliğinin farklı olduğunun bilincindeyiz veya depresyona, anksiyeteye, psikolojik sıkıntılara ve nörolojik hastalıklara sahip bireylerin sağlıklı bireylere kıyasla farklı mikrobiyota profiline sahip olduğu da aşikârdır. [11] [12] [20]. Ancak bu farklı mikroorganizmaların hastalıklardaki işlevi; hastalığın hangi aşamasında devreye girdiği, hastalığı gut mikrobiyotasının başlatıp başlatmadığı gibi soru işaretleri bulunmaktadır. Ya da bazı nörodejeneratif hastalıklarda (Huntington, Alzheimer ve Parkinson hastalığı gibi) ortak bulunan mikroorganizma türleri rapor edilmiştir. Bu canlılar neden bu hastalıklarda ortak bulunmakta, benzer etkinlik mi göstermekte veya bu ortak mikroorganizmalar neden sağlıklı bireylerde görülmemekte? Bu gibi sorular hâlâ belirsizdir ve araştırılmayı beklemektedir [33].
1 Genlerin dizisini değiştirmeden genin aktif veya pasif olma durumunun etkilenmesini sağlayan düzenleyici mekanizmalar.
2 Gastrointestinal sistem organları ve merkezi sinir sistemi arasındaki karşılıklı iletişim yolağına verilen terim.
3 Gut; gastrointestinal sistem organlarını içeren vücut bölümüdür.
4 Gut mikrobiyotası; gastrointestinal sistemdeki mikroorganizmaların oluşturduğu sistem.
5 Biyolojik canlı sınıflandırılmasında, sınıfların bir araya gelmesiyle oluşan birliğin adı.
6 Lat. meconium. On altıncı haftadan itibaren dölütün bağırsaklarında biriken ve doğumun ardından birkaç gün süreyle dışarı atılan, karaciğer, bağırsak salgıları ve amniyon sıvısındaki artık maddelerden oluşan, koyu yeşil renkli ve yapışkan nitelikte dışkı. [İlaç ve Eczacılık Terimleri Sözlüğü, 2014].
7 Tam açılımı gama amino bütirik asit olan GABA; engelleyici etkiye sahip bir nörotransmitterdir.
8 5-Hidroksitriptamin diğer ismiyle serotonin duygularda, bilişsel özelliklerde, öğrenmede, hafızada ve birçok karmaşık olaylarda görevli nörotransmitter.
9 Merkezi sinir sisteminde çalışan bağışıklık sistemi hücreleridir.
10 İng. Neural; sinirsel, sinirlerle ilgili anlamına gelen terim. [İlaç ve Eczacılık Terimleri Sözlüğü- 2014]
11 Bağırsak yüzeyini kat ve kat arttırabilen, kan yoluyla taşınan besin değerlerinin emilimini gerçekleştiren çıkıntı benzeri yapılar.
12 Hipotalamus, hipofiz ve böbrek üstü bezleri arasındaki etkileşim. Bu etkileşimler; stres cevabı, sindirim sistemi, bağışıklık sistemi, duygu ve ruh hâlinin düzenlenmesini de kapsayan birçok süreci düzenlemektedir.





