Yazan: Bert Hubert
Çeviren: Ümit Sözbilir
Düzenleyen: Çisem Özge Biçer & Esranur Maral
Özet: Bu yazıda COVID-19 aşılarının kaynak kodu ve proteinlerinin harf çözümlemeleri yapılmış olup aşıların karşılaştırılmalarına da yer verilmiştir.
Daha önce yapılan BioNTech/Pfizer SARS-CoV-2 Aşısının Kaynak Koduna Tersine Mühendislik çalışmasının devamı olarak bu çalışmada bazı aşıların arkasındaki genetik kodu inceleyeceğiz. Değiştirilmiş mRNA bazları ve genetik bilgiye göre protein üretimi düzeneği konusunda yeterince bilgi sahibi değilseniz önceki gönderiyi gözden geçirmenizi tavsiye ederim.
Tüm aşı çalışmalarıyla ilgili tam teşekküllü bilgilere sahip olmak için Derek Lowe ve Hilda Bastian‘ın gönderilerine bakabilirsiniz. Derek ve Hilda, neredeyse ilgili tüm gelişmeleri yakından takip ediyor. Son güncellemelerden haberdar olmak için onların yazılarını kontrol ettiğinizden emin olun.
Bu yazıda, hâlihazırda piyasada bulunan veya piyasaya girecek olan başlıca SARS-CoV-2 aşıları arasındaki genetik farklılıklara odaklanıyorum.
Özetle, (neredeyse) hazır olan dört ana aşı türü vardır: mRNA, viral taşıyıcı, protein alt birimi ve zayıflatılmış/etkisizleştirilmiş virüs.
Etkisizleştirilmiş veya zayıflatılmış virüs temelli aşılar, temelde SARS-CoV-2 virüsünün ölü veya zararsız bir hâlini ve ayrıca bağışıklık sistemimizi eyleme geçirip aşının etkinliğini arttırmak için tasarlanmış bir “yardımcı[1]” içerir. Genetik açıdan bu tür aşılar hakkında söylenecek çok şey yok, bu yüzden bu kategoriyi açıklamayı başkalarına bırakacağım.
mRNA ve viral taşıyıcı aşılarının her ikisi de kendi hücrelerimizden bazılarını, SARS-CoV-2 virüsünün küçük ama hayati bir parçası olan ünlü spike proteinini (S proteini) üretmeye zorlar. Eğer bu tür aşılar işe yararsa vücudumuz hem S proteinine hem de bu proteini ürettiğine dair temel belirtiler gösteren hücrelere karşı tam bir bağışıklık sistemi tepkisi oluşturur.
Protein alt birimi aşıları zerk edildikleri esnada doğrudan S proteinini de vücuda iletirken aynı zamanda bir bağışıklık sistemi tepkisine yol açacak şekilde hazırlanır.
Bu yazıda şunlara inceleyeceğiz:
- BioNTech/Pfizer/Fosun: BNT162b2 veya bilinen adlarıyla Tozinameran ya da Comirnaty. Değiştirilmiş bir S proteini üretimine yol açan, lipit nanoparçacık içinde değiştirilmiş mRNA ihtiva eden bir mRNA aşısı.
- Moderna: mRNA-1273. Değiştirilmiş bir proteini üretimine yol açan, lipit nanoparçacık içinde değiştirilmiş mRNA ihtiva eden bir mRNA aşısı.
- Curevac: CVnCoV, değiştirilmiş bir S proteini üretimini sağlayan, lipit nanoparçacık içinde değiştirilmemiş mRNA ihtiva eden bir mRNA aşısı.
- Oxford/AstraZeneca: AZD1222, diğer adıyla Oxford–AstraZeneca aşısı, Covishield veya ChAdOx1 nCoV-19. Değiştirilmemiş S proteini üretimini sağlayan bir viral taşıyıcı aşısı.
- Janssen/Johnson & Johnson: Ad26.COV2-S ya da diğer adıyla JNJ-78436735. Değiştirilmiş bir S proteini üretimini sağlayan bir viral taşıyıcı aşısı.
- Gamaleya Epidemiyoloji ve Mikrobiyoloji Araştırma Enstitüsü: Sputnik V veya diğer adıyla Гам-КОВИД-Вак ya da namı diğer Gam-COVID-Vac. İki farklı virüs kullanan bir viral vektör aşısı, S protein değişimi bilinmiyor ama bir Twitter hesabı var!
- Novavax: NVX-CoV2373. Özel bir “yardımcı” kullanan, iki kez değiştirilmiş S proteini içeren bir protein alt birimi aşısı.
Yukarıdaki listede de göreceğiniz üzere değiştirilmiş veya değiştirilmemiş mRNA aşıları ve S proteinleri vardır. Bu listede bulunan CVnCoV, Ad26.COV2-S ve NVX-CoV2372 herhangi bir pazarlama izni alamadı. Buna karşın geriye kalanı geniş veya biraz daha geniş kullanıma sahiptir.
mRNA Aşıları: BioNTech, Moderna, CureVac
Önceki yazıda, BioNTech/Pfizer aşısının hücrenin kendi bağışıklık düzeneğinden kaçmak için değiştirilmiş mRNA’yı nasıl kullandığını anlatmıştım. Derek Lowe, RNA Aşıları ve Lipitleri yazısında bu konuyu ele alıyor:
“Kendi doğal kuzenleri gibi ribozomda okunan aynı zamanda mRNA zincirini hem daha kararlı hem de kendisine karşı bir bağışıklık tepkisi başlatma olasılığı daha düşük hâle getiren pseudouridine/1-methylpseudouridin gibi değiştirilmiş bazlar da var.”
Hem Moderna hem BioNTech/Pfizer aşısı değiştirilmiş mRNA kullanmasına rağmen bu aşıların aynı değiştirme yöntemini kullanmadıklarını düşünüyorum. Buna karşın birçok yönden Moderna ve BioNTech aşıları birbirine çok benziyor. Ne yazık ki Moderna kendi aşısının RNA dizisini yayımlamadı, bu yüzden doğrudan karşılaştırma yapamıyoruz.
CureVac’ın CVnCoV aşı adayı normal mRNA kullanır ancak bu mRNA’nın da oldukça özel olarak tasarlanmış bir kuyruğu vardır. Bu konuyu biraz merak ettim ve LinkedIn’de CureVac’ın kurucusu olan Ingmar Hoerr’e şans eseri bu soruyu sorabildim.
Soruma verdiği yanıtı herkese açık olarak yayımladı (ki bu onun için çok hoş bir şey):
“Kimyasal değişim yapmanın gerekçesi nedir? Kariko ve Weismann tarafından yayımlanan yazıda da cevabı görüldüğü üzere genetik şifrelerin değiştirilmesi bağışıklık sisteminin yanıt oluşturmasından kaçınan proteinlerin üretimi için gereklidir. Söz konusu aşılar olunca böyle bir değişime ikna olmadım.”
Şu an baktığımızda Hoerr’in tam bir mRNA şirketi kurduğunu görüyoruz. Bu yüzden neden bahsettiğini bildiğini varsaymalıyız.
Değiştirilmiş mRNA bazlarını kapsayan patentler var. Bu nedenle değiştirilmiş RNA kullanmamak için fikrî mülkiyet nedenleri olması gayet mümkündür. Buna karşın CureVac attığı bir tweette fikrî mülkiyet haklarının çalışmalarında etkin bir rol oynadığını reddetti:
“Merhaba, mRNA teknolojisinin öncüleri olarak her zaman elimizde mRNA özelliklerinin ince ayarını olası kılan değiştirilmemiş mRNA’yı en iyi hâle getirmeye odaklandık. Teknolojimiz fikrî mülkiyet ile ilgili konular tarafından yönlendirilmiyor ancak farklılaştırılmış bir eylem yöntemi sunan güçlü bir yaklaşıma sahip.”
Normal mRNA bağışıklık sistemimizi bir nevi harekete geçirir ve bu nedenle bir aşının etkinliğini muazzam ölçüde artırabilen muhtemel bir yardımcı maddedir. Bunun yanı sıra araştırmalar, değiştirilmiş mRNA’nın taşıdığı genetik şifreye göre protein üretiminin normal mRNA’ya nazaran iki kat daha iyi olduğunu gösteriyor gibi görünüyor. Bu yüzden, basit mRNA kullanmanın bu kadar iyi bir fikir olup olmadığından emin değilim. CVnCoV’un hayvan testlerindeki başarısı şimdiye kadar bir şekilde “eh işte” seviyesindedir.
Viral Taşıyıcı Aşıları
BioNTech/Pfizer SARS-CoV-2 aşısı ile ilgili önceki yazımda belirttiğim gibi mRNA aşıları hücrelerimize değiştirilmiş bir miktar mRNA ileterek S proteinleri oluşturması için aslında vücudumuzu bir nevi kandırıyor. Hücrelere iletilen bu mRNA dizileri, hücrelerin görev bilinci gereği olağan süreçte olduğu gibi okunur ve S proteinleri üretilir.
Söz konusu mRNA aşıları çok iyi çalışıyor ve bunun nedeni de muhtemelen sadece S proteinleri üretmekle kalmayıp bu işi virüslere oldukça benzer bir şekilde yapmalarıdır. Bu gerçek bir düzeneğe çok benzediği için bu aşıların bağışıklık sistemimiz adına son derece eğitici olmalarını sağlıyor.
Oldukça virüs benzeri bir düzenek oluşturmanın bir başka yolu da gerçek ama zararsız bir virüs kullanmak ancak öncelikle bu virüsü SARS-CoV-2 S proteinini üretme talimatlarıyla donatmak gerekmektedir.
Yapılan viral taşıyıcı aşısı size sınırlı bir şekilde zararsız bir virüs bulaştırır ve bu virüs bir süre sonra tıpkı mRNA aşılarının yaptığı gibi S proteinini üretir. Bu da daha sonra bağışıklık sistemini harekete geçirir.
Oxford/AstraZeneca, Janssen ve Sputnik aşılarının tümü bir “taşıyıcı” olarak değiştirilmiş adenovirüsleri kullanır. Bu adenovirüs taşıyıcılara Oxford’da “ChAdOx1” denir. ChAdOx1 biri insandan diğeri ise maymundan olmak üzere iki farklı adenovirüsten türetilmiştir:
“ChAdOx1, maymun adenovirüs (ChAd) alt tür Y25’ten türetilmiştir ki bu taşıyıcı insan adenovirüs HAdV-C5’ten gelen taşıyıcıların doğal olarak sahip oldukları E4 orf4, orf6 ve orf6/7 genlerini değiştirmek için λ kırmızı yeniden birleşimiyle tasarlanmıştır.”
Janssen, Ad26’ya dayanıyor ve bunun ilk olarak 9 aylık bir bebekten yalıtıldığını bilmek sizi memnun edebilir:
“Adenovirüs tip 26 (Ad26) vahşi tip virüs ilk olarak 1956’da 9 aylık bir erkek çocuğun anal örneğinden yalıtıldı.”
Yalnız bahse girerim bunu bilmeniz gerekiyordu.
mRNA aşıları ve viral taşıyıcı aşı tipleri arasında bazı önemli farklılıklar vardır. Adenovirüsler sağlam çift sarmallı DNA virüsleridir. mRNA aşıları, sıkı soğutma ve işleme gereksinimleri ile birlikte geliyor.
DNA, RNA’ya kıyasla son derece kararlıdır. Örneğin, 50.000 yıllık iskeletlerden DNA elde etmek bizim için sıradan bir iş. Adenovirüs temelli viral taşıyıcı aşılarının özel bir soğutmaya ihtiyacı yoktur ve bunları dilediğiniz zaman sallayabilir hatta doğrudan güneş ışığı altında aşılama yapabilirsiniz. Bunlar çok önemli artılardır.
Virüsler ayrıca kendilerini kopyalamaları açısından son derece verimli olacak şekilde değiştirildi. Bir gram virüs zaten şaşırtıcı bir miktar olsa da Janssen şu anda 1.000 litrelik fıçı kullandıklarını bildirdi.
Mevcut durumda, bir virüs taşıyıcı aşısı alırsanız hem viral taşıyıcıya hem de taşıyıcıdaki S proteinine karşı antikorlar geliştireceğiniz endişesi içinde olabilirsiniz. Bu durum, böyle bir tekniği kişi başına tam olarak sadece bir kez kullanabileceğiniz anlamına gelebilir.
Görünüşe göre aslında bu bir sorun değil hatta belki de viral taşıyıcı bağışıklık sistemimizi fazla etkilemeyecek kadar değiştirilmiş bile olabilir:
Şimdiye kadar yapılan klinik çalışmalarda, Ad26’ya karşı doğal veya taşıyıcı kaynaklı önceden var olan bağışıklığın aşının kazandırdığı bağışıklık yetisi üzerindeki açık (bir) etkisi gözlemlenmemiştir. Ad26 temelli aşılama yaklaşımlarının tekrarlanan uygulamasını değerlendiren klinik deneylerden elde edilen sonuçlar, ikinci veya sonraki bir çalışma aşısı dozunun vücut sıvılarını ve hücresel bağışıklık tepkilerini artırabildiğini gösterdi. Kendisini kopyalama yeteneği olmayan Ad26 viral taşıyıcılarına dayanan aşılar, risk/fayda değerlendirmesi için önemli hususları içeren standartlaştırılmış şablondur.
Vektör taşıyıcılarında önemli bir değişiklik ise çoğalmamalarıdır. Bu da bu taşıyıcılara karşı etkin bir bağışıklık tepkisi oluşturmamak için önemli olabilir.
Oxford/AstraZeneca Aşısı
Ne söyleyebilirim. Bu aşı oldukça karmaşık bir test sürecinden geçti. Birkaç farklı test yöntemi vardı ve bunların sonuçları birleştirildi. Aşı dozu yanlış ayarlandığı için verilerin bir kısmı bozulmuş olabilir. Ayrıca yan etkilerle ilgili hoş olmayan bazı davalar da var. Sonuç olarak pek çekici bir hikâyeye sahip değil.
Bu, elbette aşının kötü olduğu anlamına gelmez ancak biraz karmaşık bir durumda olduğu da su götürmez bir gerçektir.
12 Ocak’ta AstraZeneca, Avrupa İlaç Ajansına koşullu pazarlama izni için başvurdu ve şansı yaver giderse sunulan veriler netlik sağlayacaktır. Avrupa İlaç Ajansına bağlı olmayan bazı devletlerin hükûmetleri aşıyı çoktan onayladı bile. Verilere ilk bakıldığında, aşının 65 yaş ve üstündeki kişiler için oluşturacağı etkiler hakkında çok az şey biliniyor gibi görünüyor.
Yine de bir şey doğrudan göze çarpıyor: AZD1222, değiştirilmemiş S proteinini kullanan tek aşıdır.
Öyleyse neden bu proteini değiştirelim ki?
Gerçek bir SARS-CoV-2 parçacığına bakarsanız “S protein” proteinini bir sürü sivri uç şeklinde görebiliriz.
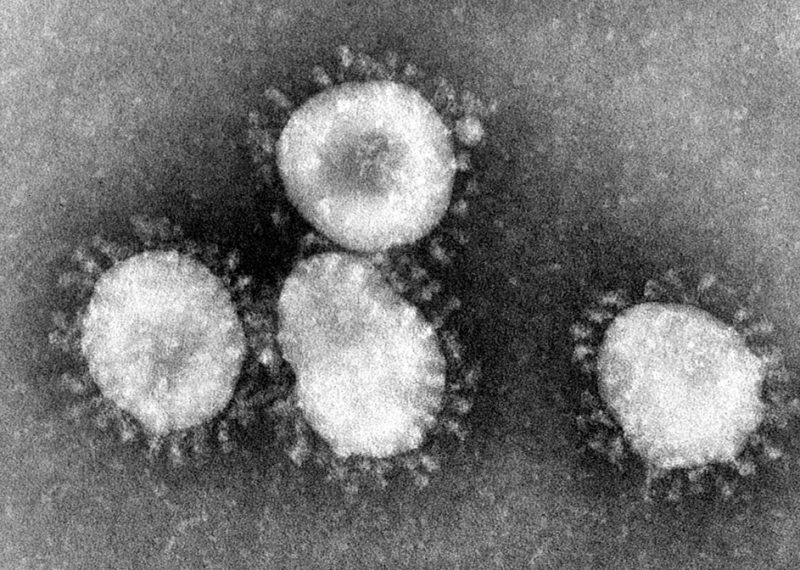
Bu sivri uçlar, viral bir bulaşının “kaynaşma” süreciyle yani virüsün konak hücreye girmesi ilgilidir. Önceki yazımda bundan biraz bahsetmiştim ancak izninizle burada biraz daha ayrıntı vermek istiyorum.
Bu sivri uçların biçimleri, kaynaşma öncesinde SARS-CoV-2 virüsünün dış tarafına doğru gömülü hâldedir ve bu hâldeyken oldukça kararlıdırlar.
S proteinin kaynaşma işinde başarılı olduğunu görmenin yolu şudur: Eğer S protein kaynaşma işinde başarılıysa kaynaşma sonrası durumda daha düşük bir enerjidedir Bir diğer açıdan bakılırsa S protein, kaynaşma öncesinde oldukça yüksek bir enerjidedir. Belki bunu ayarlanmış bir fare kapanına benzetebiliriz. S proteini kaynaşma şansı yakaladığında bu gerilim (enerji) kaynaşma sürecinde salınır.
Bu durum göz önüne alındığında bir virüs virüsün dış kısmına yerleşmemiş bağımsız bir S proteinin, kapanan bir fare kapanı gibi daha düşük bir enerji durumuna geri dönmesi bir mucize değildir.
Bu sefer bir başka sorun ortaya çıkıyor ki o da bağışıklık sistemimizin kaynaşma öncesinde S proteine karşı bağışıklık geliştirmesini istememizdir. Ancak yalnız bırakıldığında S protein çökebilir ve bu daha az kullanışlı bir antikor dizisine yol açabilir. Bu durumda oluşan antikorlar yanlış şey için ayarlanmışlardır yani kaynaşma sonrası S proteinine göre bağışıklık kazanmışlardır.
Yakın zamanda, jüri bunun ne kadar sorun olduğu konusunda tartışmalar yaşadı. Diğer bazı virüsler için (RSV gibi) protein yapısının etkisi çok büyük olmuştur.
Çoğu SARS-CoV-2 aşısı aşının insan hücreleriyle kaynaşana kadar daha kararlı hâle gelmesini sağlamak için iki aminoasiti prolin aminoasitiyle değiştirilmiş bir S proteini kodlayan bir gen dizisi kullanmayı seçiyor. Laboratuvar testlerinde, bu değişimin faktör 50 aracılığıyla artmış protein üretimi geliştirdiği gözlemlendi. Daha ileri HexaPro değişimleri daha da etkileyiciydi.
Oxford/AstraZeneca aşısı, değiştirilmemiş S protein şifresi bulunduran mRNA içerir ve bunun şu ana kadar bildirildiği gibi biraz hayal kırıklıkları yaratan başarı düzeyiyle ilgili bir etmen olup olmadığını bilmiyoruz. Fikrî mülkiyet hususlarının değişimin kullanılmasından önce bir rol oynayıp oynamadığını merak edebiliriz.
Not: AZD1222, burun içine uygulandığında iyi işlev görebilir. Bir çalışma, bu aşının kas içine zerk edilmesindense burundan alındığında daha başarılı olduğunu gösterdi.
Janssen Ad26 aşısı “2PP” değişimini yani iki aminoasitin proline dönüşümünü içeriyor ve sözüm ona 21 Ocak’ta yapılacak antikor sayımlarını endişeyle bekliyoruz. İlk antikor sayıları umut verici görünüyor.
Janssen aşısının çok kararlı tek seferlik bir çözüm olması mümkün olabilir ve eğer gerçekten böyleyse bu harika olur.
Son olarak Sputnik V aşısı, biri Ad5’ten diğeri Ad26’dan türetilen bir değil iki farklı viral taşıyıcı kullanır. Sputnik V’in duruşmaları oldukça karışık ve tartışmalı geçmiş olup verilen bazı hükûmet onaylarının da doğruluğu tartışmalıdır. Aşının içeriği veya S proteininin herhangi bir şekilde değiştirilip değiştirilmediği de iyi bilinmemektedir ancak bu yine de değerli bir aşı olabileceği gerçeğini değiştirmez.
Protein Alt Birimi
Aşının içinde DNA ve RNA olmadığından dolayı yazının bu kısmı biraz garip gözükebilir.
Diğer aşılar bir şekilde tıpkı IKEA’nın ürettiği kendin yap yapısı gibi olsa da Novavax NVX-CoV2373 doğrudan kararlı bir S proteini zerk eder.
Bu protein, 27,2 nm’lik bir nanoparçacık içinde kapsüllenmiştir.
NVX-CoV2373, iki aminoasidi prolin aminoasidiyle değiştirilen S proteinini içerir. Bunun üzerine bu S proteinini, proteinleri yıkan enzimlere karşı korumak için üç aminoasit daha değiştirilir (682-RRAR-685 ila 682-QQAQ-685). Bu da muhtemelen proteinlerin yeterince uzun süre kalmasına ve böylece bağışıklık sisteminin çalışmaya başlamak için ihtiyaç duyduğu zamana izin verir.
Bu aşı, hiçbir hücreye gerçekten bulaşmış olmadığından bağışıklık sistemimizi harekete geçirecek bir yardımcı maddeye ihtiyacı duyar. Bu yardımcı madde, heyecan verici “Matrix-M” adıyla anılır ve genellikle bir bitkiden türetilen “saponin” adlı bir organik kimyasala dayanır.
Bu birleşim de iyi çalışıyor gibi görünüyor. Bu durumda fiilî S proteini kendi hücrelerimiz tarafından değil bakulovirüs bulaşısına uğramış böcek hücreleri tarafından yapılır.
Sonuç
Çok sayıda etkisi kanıtlanan veya ümit verici aşı var. Bu aşılardan bazıları değiştirilmemiş RNA kullanır, bazıları değiştirilmiş RNA kullanır ve bazıları ise adenovirüs yapıları kullanır.
Her biri temelde S proteini yoluyla etki ediyor olsa da kimisi değiştirilmiş mRNA ve S proteini, kimisi yalnız birinin değiştirilmiş hâlini, kimisi ikisinin de normal hâlini içeriyor. Sputnik V için henüz bir bilgimiz yok ancak belki Twitter hesabından aşının üreticilerine sorabiliriz.
Adenovirüs kökenli kimi aşı adaylarının ne kadar iyi çalıştığını kısa zaman içinde öğreneceğiz ancak bazı ilk işaretler şimdiden çok umut verici gözüküyor. Aynısı NVX-CoV2373 için de geçerli.
[1] (İng.) adjuvant.