Chaperone (Şaperon) Protein
Yazan: Nurdan Arıcan
Düzenleyen: Ümit Sözbilir
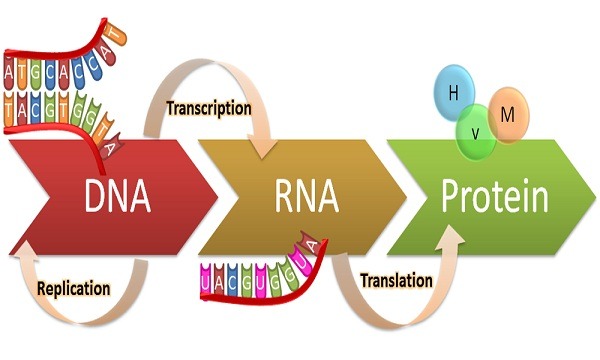
Özet: Genetik materyalimizi taşıyan DNA’dan[1], proteine doğru meydana gelen bilgi akışı sonucu -santral dogma[2] sırasında- oluşan polipeptid[3] zincirinin işlevsel hale gelebilmesi için üç boyutlu yapısına, doğru bir şekilde katlanması gerekir. Protein katlanmasının klasik prensibi, üç boyutlu yapıya ulaşabilmesi için gerekli olan tüm bilginin amino asit dizisi tarafından sağlanmasıdır. Bu proteinlerin, hücre içerisinde doğru katlanabilmesi için başka proteinlerin aktivitelerine ihtiyaçları vardır. İşte proteinlerin katlanmasını kolaylaştıran ve yapılarını koruyan bu refakatçi proteinler, şaperonlar olarak adlandırılır. Ancak yanlış ve eksik katlanma sonucu oluşan hasarlar, ciddi ve yaygın hastalıklara da yol açmaktadır.
Şaperon protein öncül olarak polipeptid katlanması ile ilgilidir yani katlanan proteinin yapısına dahil olup herhangi bir değişikliğe yol açmazlar. Birçok biyokimyasal araştırma sonucu, protein katlanması sırasında şaperon mevcut ve işlevsel ise polipeptid zincirinde yığın ya da hatalı katlanmanın önlendiğini göstermiştir.
Şaperonlar, diğer proteinlerin katlanmasını ve açılmasını veya protein-protein, protein-DNA ve protein-RNA komplekslerinin birleşmesini ve ayrılmasını düzenleyen oldukça etkileşimli bir protein grubu olarak tanımlanır (Hartl FU, 2002). Şaperon protein ailesi 2 genel gruba ayrılır: Moleküler şaperonlar ve şaperoninler. Moleküler şaperonlar (Hsp70, BiP, DnaK gibi) katlanmamış ya da kısmi katlanmış proteinlere bağlanarak onları düzeltir. Şaperoninler (Hsp60, GroEL gibi) ise proteinlerin doğru katlanmalarını sağlar. (Bakıcı, 2012) Her iki ailenin proteinleri de polipeptid zincirlerinin katlanmamış bölgelerine tutunur. Ayrıca Hsp70 ve şaperonin aile üyeleri, bakterilerin ve ökaryotik hücrelerin sitozollerinde[4] ve hücre içi organellerinde mevcutturlar.
Translasyon[5] sırasında moleküler şaperon ailesinin üyeleri katlanmamış polipeptidlere bağlanır ve onların yapısını korur. Katlanmamış proteinler daha sonra katlanmanın gerçekleşeceği şaperonin ailesinin üyelerine transfer edilir. Bazı şaperonlar foldases[6], bazıları holdases[7] olarak çalışır. Bu transfer sırasında ihtiyaç duyulan enerji ATP[8] hidrolizinden sağlanır (foldases). Şaperonin, moleküler şaperonlar ile korunan ara formu doğru formuna katlar. Bu aşamada da enerji ATP’den sağlanır.

Şaperon yokluğunda, katlanmamış ya da yarı katlı kalmış polipeptidler de şaperonlar tarafından stabilize edilir ve düzenlenir. Yani şaperonlar zamanı gelmeden katlanan, yarı katlı kalmış ya da yanlış katlanmış polipeptid zincileri için bir düzenleyicidir. Translasyon sırasında ribozom üzerinde sentezlenmekte olan polipeptid zincirinin N-ucuna[9] tutunan şaperon, sentez bitmeden polipeptidin N-ucunun kümelenmesini önler. Ardından sentezlenen zincir, ribozomdan ayrıldığında üç boyutlu yapısına katlanabilir.

Birçok şaperon türü Isı Şok Proteini/Heat Shock Protein (HSP) olarak ifade edilir. Isı şok proteinleri hücrelerin yüksek ısıya (42-46°C) maruz kalması sonucu üretimi artan bir protein grubudur. Bu artışa yol açan olay çoğunlukla sıcaklık etmeni tarafından düzenlenir ve ısı şok cevabı olarak adlandırılır. Bu nedenle I.Ş.P.’ne “stres proteinleri” de denmektedir. (Ersin Öztürk, 2009) Isı şok proteinleri, yüksek sıcaklık veya herhangi bir hücresel strese (pH derecesi, oksijen seviyesi, açlık, ağır metaller vs.) karşı duyarlıdırlar. Bunun nedeni proteinlerin ve katlanma sürecinin ısı başta olmak üzere diğer çevresel etmenlerden de ciddi derecede etkilenmesidir. Bu duyarlılık evrimsel süreçte de çok büyük rol oynamıştır çünkü hücre herhangi bir stres etmeni ile karşılaştığında ya buna yenilmek ya da buna uygun adaptasyon[10] geliştirmek zorunda kalır. Örneğin hücre yüksek sıcaklığa maruz kaldığında buna direnç gösterebilen ısı şok proteinleri devreye girer ve diğer proteinleri korumaya alır. Bu sebeple ısı şok proteinleri ve protein katlanma sürecinde görev alan proteinlerin ısı şok proteini olması canlılığın devamı için de evrimsel açıdan da önemlidir. Organizmada en çok görülen HSP aileleri HSP60, HSP70 ve HSP90 aileleridir.
Diğer şaperon türleri, -örneğin ökaryotlardaki ER[11] ve Mitokondri[12] organelleri için- protein aktarımı sırasında membranda[13] görev almaktadırlar. Kısmi katlı olan polipeptid zincirinin sitozolden, burada bahsedeceğimiz organel olan mitokondriye aktarımı sırasında görev alan proteinlere sitolozik şaperonlar denir. Mitokondrinin hücre zarına gelindiğinde ise bu proteinler zardan geçecek kadar küçük olmadıkları için zincirden ayrılırlar. Polipeptid zinciri mitokondri içine girdiğinde ise zincire bu sefer mitokondri şaperonları bağlanır ve bu yapıyı korumaya devam ederler. Organel içindeki polipeptid zinciri, mitokondri şaperonları sayesinde doğru katlanmış olur.

Protein Katlanma Bozuklukları
Protein katlanmasındaki hatalar birçok ciddi ve yaygın hastalığa yol açabilir. Protein katlanma hastalıkları merkezi sinir sistemine[14] özel değildir; periferik[15] dokularda da görülebilirler. Bunlar Tip 2 Diyabet, Katarakt, Kistik fibröz, Amiloidoz olabilir. Sinir sisteminde meydana gelen yanlış katlanma ya da birikmeler sonucu da Nörodejeneratif hastalıklar meydana gelmektedir. Bunlar ise Alzheimer, Parkinson, Huntingon olabilir.

Bu hastalıklar, özgül proteinlerin hatalı katlanarak dokularda “amiloid”[16] adı verilen fibril [17] yapısındaki proteinlerin, ekstrasellüler[18] birikimi ve organlarda işlev bozukluğu ile meydana gelmektedir. Biriken fibriler proteinler çözünemezler ve enzimlere[19] direnç gösterirler. Bunlar protein yapısındaki hatalı katlanmalara bağlı gelişmektedir. Bu hasarların ortak mekanizması ise kısmen katlanamamış olan proteinlerin oluşturduğu polimerlerin[20] ortaya çıkmasıdır. Amiloid hastalıkları fibril proteinlerin biyokimyasal yapısına, birikimlerin lokalize veya sistemik oluşuna, hastalığın kazanılmış veya kalıtsal oluşuna ve kendine özgü klinik özelliklerine göre sınıflandırılır. Meydana gelen bağ dokunun sebep olduğu ve düzenlenemeyen hastalıklara sebep olan bu bozukluklar için ortadan kaldırıcı bir tedavi hala yoktur ancak çalışılmaya devam edilmektedir.
[1] Deoksiribonükleik asit; fostaf, 5C’lu şeker ve azotlu bazdan oluşur. Genetik bilgiyi saklar ve aktarır.
[2] Genetik bilginin DNA’dan RNA’ya, RNA’dan da protein sentezine aktarımı sırasında izlediği yol. DNA’daki yönergelerin işlevsel bir ürüne çevrilme süreci.
[3] Genetik bilgi aktarımı sırasında ve sonucunda sentezlenen uzun aminoasitler zinciridir.
[4] Hücrenin içi (sitoplazması), organeller ve sitozolden oluşur. Organeller dışında kalan koyu kıvamlı sıvı kısım sitozoldür.
[5] Genetik bilginin protein yapısına çevrim aşamasıdır. Santral dogmanın son aşaması olan bu kısımda; ribozomlarda, bir önceki aşamada sentezlenen amino asit sıralamasına uygun polipeptid sentezlenir, daha sonra üretilen amino asit zinciri veya polipeptit uygun bir şekilde katlanarak etkin bir protein haline gelmektedir, diğer bir deyişle yazılım aşamasıdır. (Kaynak: Vikipedi)
[6] ATP enerjisine bağlı, bunu kullanacak şekilde katlanma gerçekleştiren şaperon türleri. (GroEL / GroES ve DnaK / DnaJ / GrpE)
[7] ATP’den bağımsız bir şekilde katlanma gerçekleştiren şaperon türleri. (DnaJ ve Hsp33)
[8] Adenozin trifosfat, hücre içi biyokimyasal reaksiyonlar için gereken kimyasal enerjiyi taşıyan çok işlevli bir nükleotiddir.
[9] Amino (N) ucu serbest uç olduğu için şaperonlar bu kısma bağlanır. Diğer uç olan karboksil (C) uç sentezlenmekte olduğu için bağlıdır.
[10] Adaptasyon ve ya uyum, doğal seleksiyonda başarılı olmuş, ona sahip olan organizmayı evrimsel olarak daha uyumlu kılan bir özelliktir. (Kaynak: Vikipedi)
[11] Endoplazmik retikulum, ribozomun sentezlediği proteinleri gerekli yerlere ulaştırır, taşıyıcı organeldir.
[12] Oksijenli solunum ve ATP’nin sentezlendiği organeldir, hücrenin enerji ihtiyacını karşılar. Ökaryötik hücrelerde bulunur.
[13] Hücreyi çevreleyen yarı seçici geçirgen zar.
[14] Beyin ve omuriliği içerir. Bilgi edinebilen ve bu bilgileri işleyebilen, hücreler ağı şeklinde vücutla iletişim kuran organlar sistemidir.
[15] Sinir sistemi dışındaki dokular, çevresel sinir sistemidir. Ana işlevi merkezi sinir sistemi ile diğer organ ve uzuvlar arasındaki ilişkiyi kurmaktır.
[16] Fibröz kümelerdir, bunlar bağ dokuya dönüşüm ile oluşur.
[17] Bağ dokusunu oluşturan maddelerden biridir, uzun peptid (amino asidin amino grubu ile diğer bir amino asidin karboksil grubu arasında meydana gelen kimyasal bağ) zincirlerinden oluşur.
[18] Hücre dışı.
[19] Biyolojik katalizördür. Katalizör hücrelerde meydana gelen reaksiyonları hızlandırır.
[20] Monomer (tek parça, yapı taşı) adındaki daha küçük moleküllerin bir araya gelerek oluşturduğu uzun zincirli moleküllerdir.